使用氨硼烷为氢源的仿FLP催化的亚胺的不对称转移氢化(2016年9月)
“受阻Lewis酸碱对”(Frustrated Lewis Pairs,FLPs)是指由于位阻作用不能形成传统加合物的Lewis酸碱对。自2006年Stephan课题组发现“受阻Lewis酸碱对”能够活化氢气以来,FLP化学迅速发展成为新兴的前沿挑战性领域之一,为非金属催化氢化提供了最有效的途径,实现了多种不饱和底物的催化氢化,在不对称催化氢化领域也取得了重要进展。同时,这一新兴领域也面临着诸多挑战。手性FLP催化剂的发展主要集中在手性Lewis酸的探索上,而强酸性的手性硼烷对水、氧等较为敏感。此外,已报道的手性硼烷合成路线长、修饰困难、分离纯化难度大,严重阻碍了这一领域的快速发展。因此,发展简单易得、高效、高选择性的手性FLP催化剂是一项具有广阔应用前景的研究课题。
中国科学院分子识别与功能重点实验室杜海峰研究员长期从事手性FLP催化体系的开发及应用研究,发展了由手性烯(炔)烃与Piers硼烷原位硼氢化反应制备手性硼烷催化剂的方法(图1)。该方法操作简单,无需对催化剂进行分离纯化。此外,使用末端烯烃、炔烃避免了其它非对映异构体的生成。手性硼烷的Lewis酸性能够通过改变3,3'-位上的取代基进行调节;而手性炔烃的引入,则进一步增加了骨架的刚性,增强了手性硼烷Lewis酸性的可控性。作者利用所发展的手性FLP催化剂,成功实现了亚胺、多取代芳香杂环、烯醇硅醚的高对映选择性氢化反应(J. Am. Chem. Soc., 2013, 135, 6810; J. Am. Chem. Soc., 2014, 136, 12261; Angew. Chem. Int. Ed., 2015, 54, 623)。此外,还首次实现了1,2-二羰基化合物高对映选择性硅氢化反应(J. Am. Chem. Soc., 2016, 138, 810)。
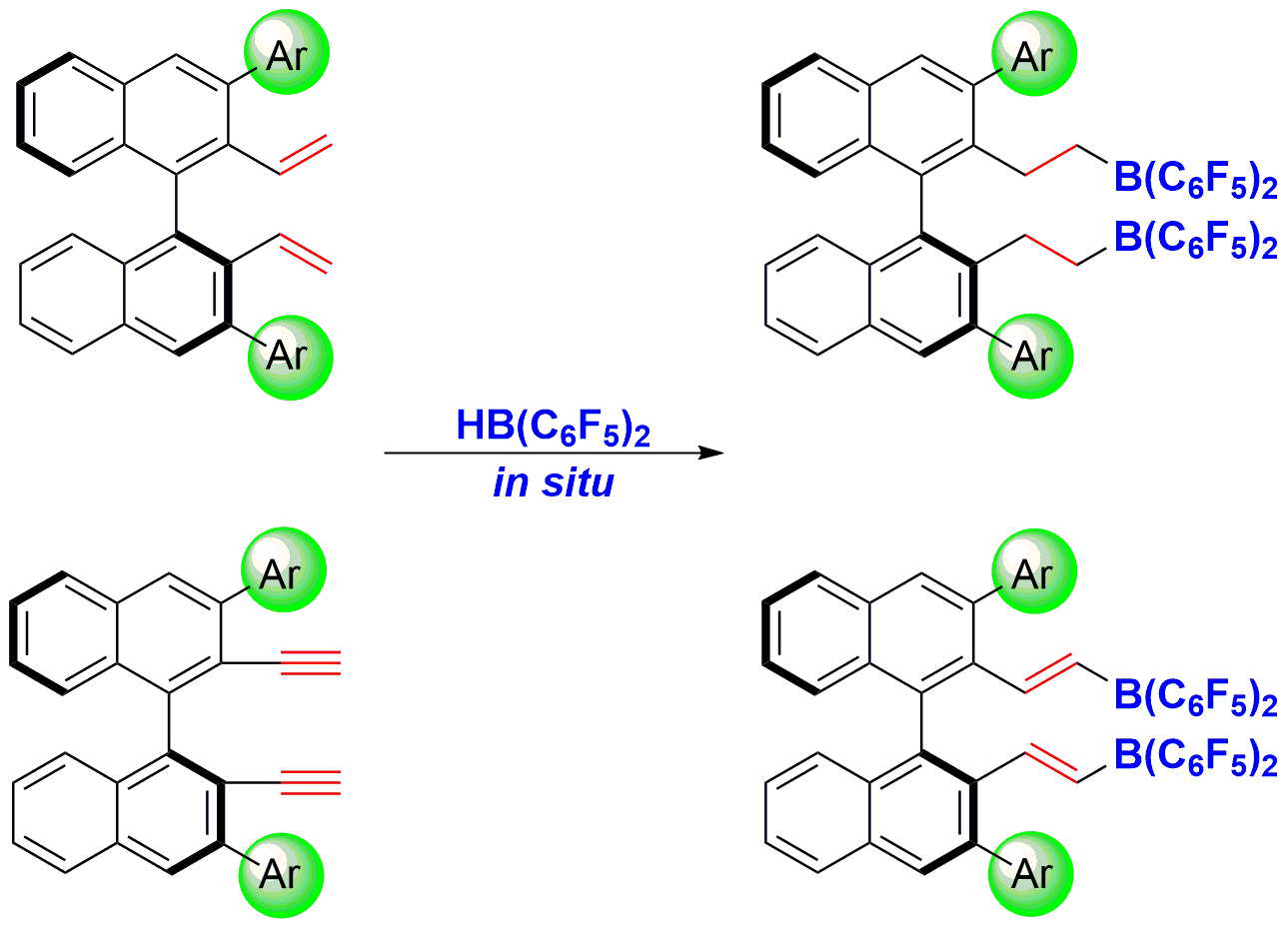
图1. 原位制备手性硼烷的新策略
传统FLP催化剂通过轨道作用对氢气进行裂解,得到带有H+和H-的鎓盐离子,再将H+和H-转移至不饱和底物得到还原产物(图2)。近期,该课题组突破传统,发展了仿FLP催化剂:由自身带有负氢的Lewis酸与带有正氢的Lewis碱组成,将氢转移到不饱和化合物后,Lewis酸碱间的键合作用使其共价成分逐渐增强,形成稳定中间体,再利用适当氢源切断该键,实现仿FLP催化剂的再生,完成催化循环(图2)。作者使用商品化的手性叔丁基亚磺酰胺与Piers硼烷组合的仿FLP催化剂,使用低分子量、高含氢量的氨基硼烷作为氢源,吡啶为添加剂,以78-99%的产率和84-95%的对映选择性实现了亚胺的不称转移氢化(图3)。这是首例利用手性Lewis碱实现高对映选择性的FLP催化转化,为手性FLP催化体系的设计与发展提供了新的思路和借鉴。
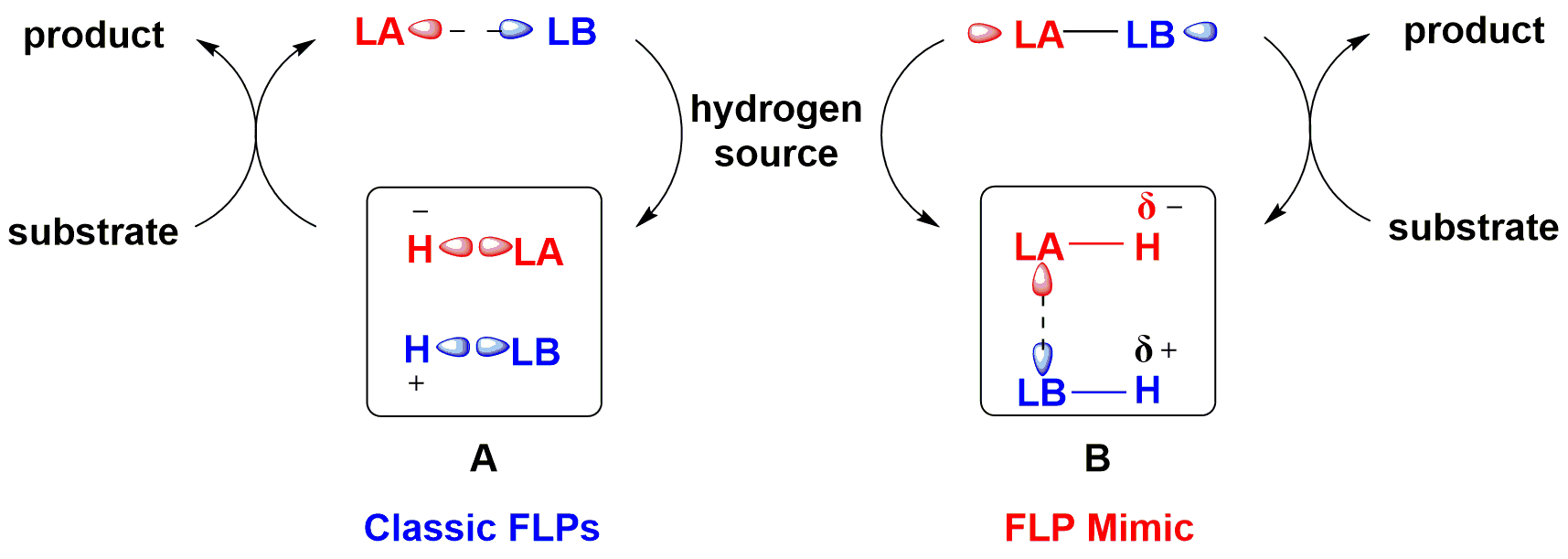
图2. 仿FLP催化策略
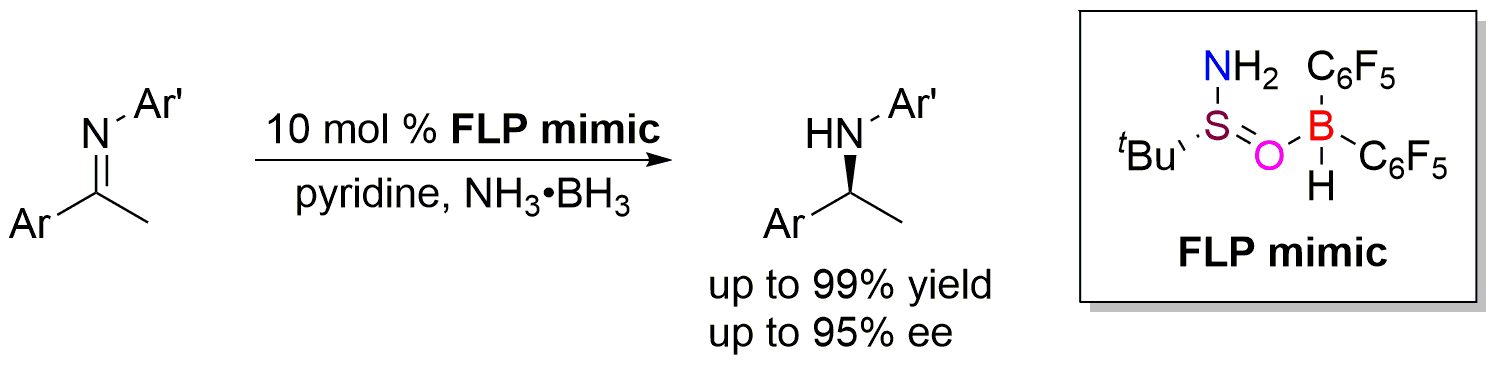
图3. 仿FLP催化亚胺的不称转移氢化
作者还结合实验手段和理论计算对反应机理进行了研究,提出可能的催化循环(图4):Piers硼烷与叔丁基亚磺酰胺形成仿FLP催化剂,通过八元环过渡态TS1实现氢转移,释放产物和脱氢中间体;此中间体与氨基硼烷通过六元环过渡态TS2,实现仿FLP催化剂的再生,由此完成催化循环。

图4. 仿FLP催化不称转移氢化可能的机理
(该工作发表在J. Am. Chem. Soc., 2016, 138, 12956–12962.)

